

• прижизненное окрашивание;
• темнопольная микроскопия;
• флуоресцентная микроскопия;
• фазово-контрастная микроскопия;
• культивирование клеток и тканей;
• электронная микроскопия;
• рентгеноструктурный анализ;
• цито- и гистохимия;
• цитоспектрофотометрия;
• дифференциальное центрифугирование;
• гистоавторадиография.
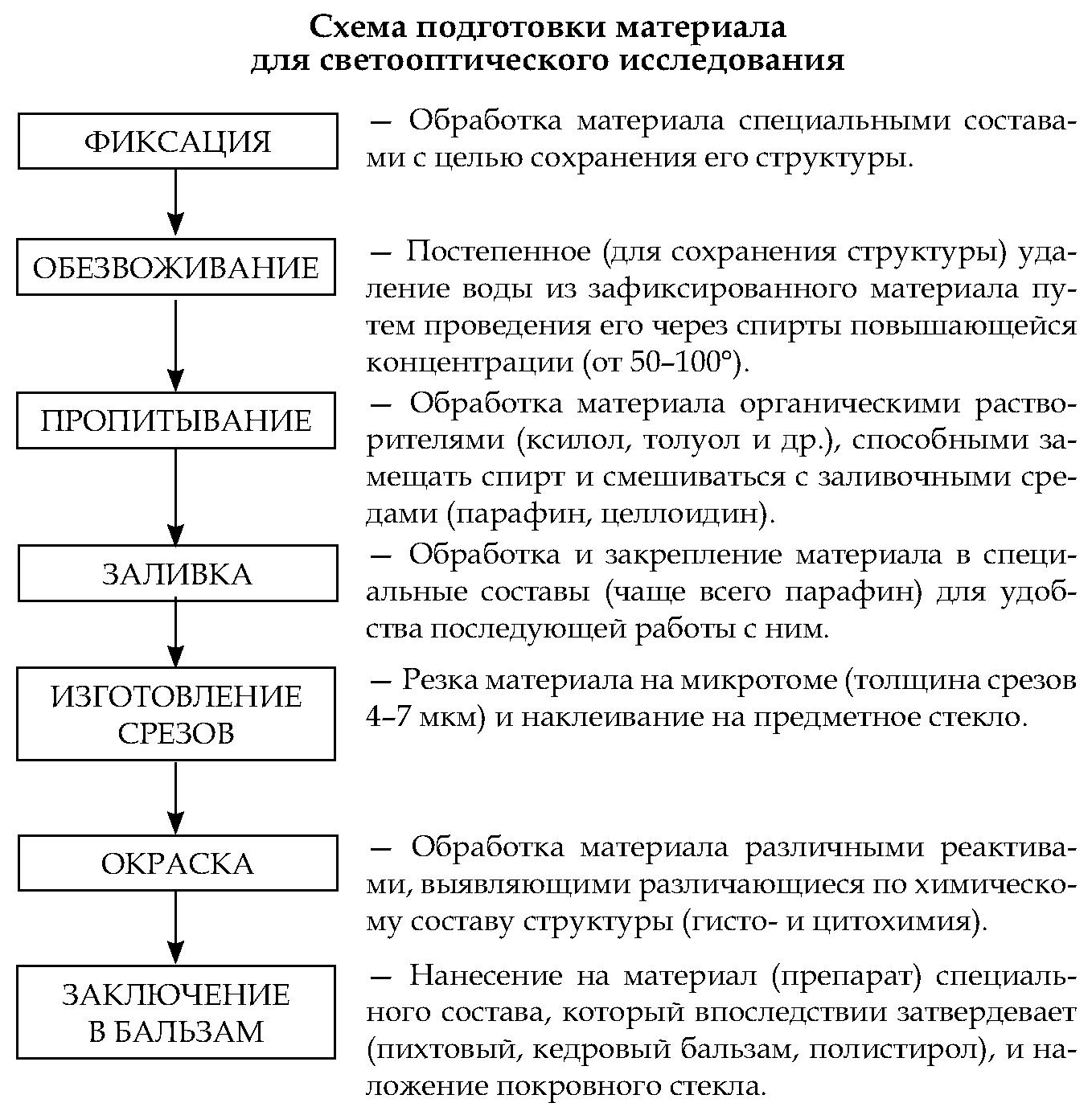
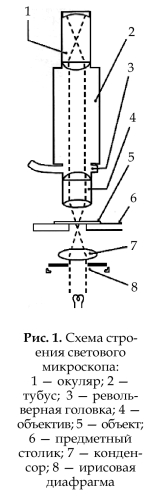 Схема строения светового микроскопа представлена на рис. 1.
Окуляр (1): увеличивает изображение, получаемое в линзах объектива; в окуляр может быть вставлена измерительная сетка, если необходимо измерить размеры объекта.
Схема строения светового микроскопа представлена на рис. 1.
Окуляр (1): увеличивает изображение, получаемое в линзах объектива; в окуляр может быть вставлена измерительная сетка, если необходимо измерить размеры объекта.Тубус (2): трубка, по которой свет проводится от объектива к окуляру; может перемещаться в штативе для фокусировки изображения объекта.
Револьверная головка (3): в нее вставлены 2, 3 или 4 объектива. Головка поворачивается так, чтобы можно было использовать объективы с разным фокусным расстоянием (а значит, и с разным увеличением).
Объектив (4): увеличивает изображение объекта.
Объект исследования (5): закреплен на прозрачной стеклянной пластине (предметное стекло).
Предметный столик (6): удерживает объект в нужной позиции по отношению к оптической системе микроскопа.
Конденсор (7): фокусирует лучи света от осветителя на объекте исследования.
Ирисовая диафрагма (8): регулирует вели-
чину светового потока к объекту. Лучшее разрешение достигается при уменьшении осве-
щения (а не при увеличении).
Для освещения чаще всего используется белый свет. Для повышения разрешения
применяется свет коротковолновой части
спектра (например, синий), излучаемый
специальной лампой или системой фильтров. Свет на объект должен падать только
из-под предметного столика. Диаметр типичной клетки приблизительно 10–20 мкм,
что в 5 раз меньше размеров мельчайшей
видимой частицы глазом, так как разрешающая способность человеческого глаза
100 мкм (0,1 мм).
Метод сравнительной микроскопиии используется для исследования двух объектов путем визуального наблюдения или фотографирования. В поле зрения микроскопа сравниваемые объекты видны одновременно. Метод используется в различных областях биоло-
гии и медицины.

Метод прижизненного (витального) окрашивания основан на использовании очень низких концентраций красителя (растворы от 0,1% до 0,01%). В такой концентрации красители являются малотоксичными для клеток. Чаще используют конгорот, нейтральный красный, трипановый синий и другие соединения ароматического ряда. В живой клетке при введении красителя наблюдается гранулообразование, в погибающей — диффузное окрашивание. По способности клеточных структур воспринимать краситель можно судить о степени повреждения клетки. Таким образом, метод позволяет судить о жизнедеятельности клеток при различных внешних воздействиях.
Метод микроскопирования в темном поле (темнопольная микроскопия) используется для рассматривания особо мелких структур (менее 0,2 мкм). Метод основан на том, что мелкие структуры, невидимые при обычном микроскопировании, светятся в отраженных лучах (эффект Тиндаля: светящиеся пылинки в луче солнечного света). Используется специальный конденсор, который пропускает только косые краевые лучи источника света. Поскольку краевые лучи имеют сильный наклон, они не попадают в объектив и поле зрения оказывается темным, а объект — светлым.
Флуоресцентная микроскопия основана на том, что некоторые вещества и структуры способны светиться (флуоресцировать, люминисцировать) при поглощении световой энергии. Для наблюдения флуоресценции используют либо фильтры, дающие освещение в сине-фиолетовой области, либо ультрафиолетовые и люминисцентные микроскопы. Собственной (естественной) флуоресцен- цией обладают: хлорофилл, витамины А, В12, некоторые гормоны. Хлорофилл при освещении в ультрафиолетовых лучах светится красным цветом. Для изучения структур и веществ, не обладающих естественной флуоресценцией, можно использовать флуорохромы (флуоресцирующие красители). Флуорохром акридиновый оранжевый избирательно соединяется с нуклеиновыми кислотами и при рассмотрении срезов в ультрафиолетовых лучах ДНК светится зеленым, а РНК — красным цветом. Таким образом, этот метод позво- ляет изучать локализацию различных химических веществ в живой и фиксированной клетке. Существуют флуорохромы, избирательно связывающиеся с липидами, полисахаридами, кератином и др.
Фазово-контрастная микроскопия основана на том, что отдельные структуры прозрачной в целом клетки отличаются друг от друга по плотности и светопреломлению. Проходя через структуры различной плотности, луч света изменяет свою фазу, но наш глаз не способен улавливать этот сдвиг фазы. Глаз чувствителен только к изменениям интенсивности света (яркости), последняя зависит от величины амплитуды световой волны. Специальный объектив вызы- вает дополнительный сдвиг фазы колебания. При построении изображения взаимодействуют уже лучи, находящиеся в одной фазе, но обладающие разной амплитудой. Тем самым создается черно-белое контрастное изображение объекта.
Методы цито- и гистохимииоснованы на способности красителей избирательно окрашивать химические вещества. Методы используют- ся для изучения химического состава тканей и клеток при сохранении их структуры, а также для определения локализации химических ве- ществ. Например, реакция Фельгена на ДНК или окраска метиловым- зеленым-пиронин на нуклеиновые кислоты (метод Браше). В основе реакции Фельгена лежит кислотный гидролиз ДНК на срезе фиксиро- ванной ткани, в процессе которого от ДНК отщепляется альдегидная группа, которая и реагирует с реактивом Шиффа (фуксинсернистой кислотой). В итоге ДНК хроматина приобретает яркую красно-фио- летовую окраску. При окраске по методу Браше пиронин связывается с РНК, окрашивает ее в розовый цвет, а метиловый зеленый связывает- ся только с ДНК, окрашивая ее в сине-зеленый цвет.
Метод цитоспектрофотометрии основан на том, что интенсивность поглощения лучей прямо пропорциональна концентрации вещества. При помощи специального прибора (микроспектрофотометра) измеряется оптическая плотность окрашенных цито- и гисто- химическими методиками субстратов (нуклеиновых кислот, белков, углеводов, ферментов). Величина оптической плотности характе- ризует концентрацию изучаемого вещества в структурах. Для количественного анализа необходимо знать площадь и объем структур (ядер, цитоплазмы), в которых измеряется оптическая плотность субстрата. Количество вещества выражается в условных единицах (ДНК можно выразить в единицах плоидности, если отфотометрировать в качестве стандарта сперматиды семенников (n) или лимфоциты крови (2n)). Метод применяется для изучения плоидности ядер, для изучения концентрации РНК, полисахаридов, белков и других веществ при развитии патологического процесса или при экспериментальном воздействии.
Метод гистоавторадиографии основан на использовании радиоактивных изотопов: трития (Н3), S35, С14 и др. Когда какое-либо вещество, содержащее радиоактивный атом, вводят в живую клетку, то клетка использует его наравне с нерадиоактивными изотопами для синтеза новых веществ. Меченый атом, таким образом, становится изотопным индикатором. Тритий используют в составе тимидина (для ДНК), уридина (для РНК), S35в составе метионина (для белка). Следы разлета частиц, которые испус кают распадающиеся радиоактивные изотопы, регистрируют путем нанесения светочувствительной эмульсии на гистологический препарат. В местах прохождения частиц светочувствительная эмульсия засвечивается, а после проявления эти участки выглядят как черные точки (треки). Чем интенсивнее изотоп включается в метаболизм, тем больше треков будет на препарате. Треки видны только над теми структурами, в составе которых появились радиоактивные молекулы. Так, например, Н3-тимидин входит в состав только молекулы ДНК, а основная масса ДНК локализована в ядре — следовательно, треки будут только над ядрами, и только над теми, в которых идет синтез ДНК. Метод используется для изучения обменных процессов (репликации ДНК, синтеза белка) на клеточном и тканевом уровнях.
Метод культивирования клеток и тканей основан на выращивании (эксплантации) изолированных клеток, кусочков тканей, орга- нов вне организма (in vitro). Различают клеточное, тканевое и органное культивирование. При клеточном и тканевом культивировании отдельные клетки или кусочки ткани выращивают погруженными в питательную среду. Такой способ позволяет сохранить морфологическую структуру культивируемых клеток, тканей. Культуры клеток дают возможность получить однородный клеточный материал в больших количествах. На клеточных культурах можно изучать физические и химические воздействия. На культурах клеток разработан комплекс специальных методов, в том числе гибридизация соматических клеток и образование гетерокарионов. При органном культивировании клетки кусочки ткани или органа (чаще всего взятые у эмбриона) выращивают на поверхности питательной среды. Кусочек органа или ткани в стерильных условиях извлекают из эмбриона, измельчают (до 0,2 мм), промывают в растворе Хенкса и помещают на поверхность мембранного фильтра, расположенного на плотике из органического стекла. Плотик помещают в чашку Петри с питательной средой так, чтобы нижняя поверхность фильтра касалась поверхности питательной среды. Питательная среда включает сбалансированный состав аминокислот, всех необходимых солей, сюда добавляется бычья сыворотка, куриный эмбриональный экстракт, витамин С, глюкоза, антибиотики. Чашки Петри помещают в термостат при 37 °С. Смена питательной среды проводится каждые два дня. При этом в стерильных условиях плотик с фильтрами и с кусочками тканей переносят в новую чашку Петри со свежей питательной средой. В таких условиях можно наблюдать за эксплантатом в течение длительного времени (28 и более суток). Органное культивирование позволяет сохранить морфологическую структуру выращиваемого органа, свойственную ему в условиях целого организма. При этом сохраняется не только морфологическая структура, но и функциональные свойства ткани, что позволяет наблюдать процессы дифференцировки, пролиферации, выявлять действие биологически активных веществ на культуру, проследить за динамикой возникающих изменений.
 Катод (1): металлический электрод (обычно платиновый), который излучает мощный
высокоскоростной электронный луч. Электроны — отрицательно заряженные частицы (e–).
Катод (1): металлический электрод (обычно платиновый), который излучает мощный
высокоскоростной электронный луч. Электроны — отрицательно заряженные частицы (e–).Анод (2): положительно заряженный электрод с напряжением 50 кВ относительно катода. Служит для ускорения электронного луча.
Конденсор (3): электронная линза, фокусирующая электронный луч на образце (4).
Шлюзовая камера для установки образца (5): позволяет поместить образец (исследуемый материал) в микроскоп без потери вакуума внутри аппарата.
Объектив (6): электромагнитная линза, которая фокусирует первое изображение и увеличивает его (в зависимости от прилагаемого напряжения).
Флюоресцентный экран (7): покрыт составом, чувствительным к столкновению с электронами. Необходим для перевода электронного изображения в световое, так как преломленный электронный луч (изображение) не может наблюдаться непосредственно.
Фотографическая пластина (9): позволяет зафиксировать черно-белое изображение. При печати на фотобумагу изображение еще больше увеличивается.
Бетонное основание (10): жестко закреплено для уменьшения вибрации и нежелатель-
ных отклонений электронного луча.
Электронная микроскопия основана на
рассмотрении объекта в проходящем пучке
электронов. Длина волны электронов при
напряжении в 100 000 Вт (100 кВт) составляет
0,04–0,05 Å1(0,004–0,005 нм) и разрешающая способность для биологических объектов в данном случае — 20 Å
(2 нм, 0,002 мкм), т. е. в 100 раз выше, чем у светового микроскопа и
достигается при увеличении в 250 000 раз, которое и является мак-
симально полезным. Последние модели электронных микроскопов
позволяют достигнуть разрешающей способности в 1 Å. Для исследования структуры клетки в электронном микроскопе требуются
ульт ратонкие срезы толщиной 400–1200 Å (40–120 нм; в среднем — 0,1 мкм), так как электроны обладают низкой проникающей способностью.

 Таким образом, разрешающая способность электронного микроскопа в 106 раз выше разрешающей способности глаза и в 103 выше,
чем разрешающая способность светового микроскопа. Различают
трансмиссионную (просвечивающую), сканирующую и высоковольтную электронную микроскопию. Трансмиссионная микроскопия
принципиально сходна со световой, но в колонне микроскопа создается вакуум, так как электроны, сталкиваясь с молекулами газов,
отклоняются и могут не достигать объекта. Использование вакуума
не позволяет исследовать живые объекты. Сканирующий микроскоп создает эффект трехмерности и способен охватывать большие
поверхности. Материал фиксируют, специальным образом высушивают, покрывают тонким слоем испаренного металла (чаще всего
золота), от которого электроны отражаются и попадают в приемное
устройство, передающее сигнал на электронно-лучевую трубку. Используется в биологии для изучения поверхности лейкоцитов, про-
стейших. Высоковольтныймикроскоп позволяет изучать более толстые (до нескольких микрометров) объекты. Это обусловлено усилением проникающей способности электронов в результате увеличения их скорости под воздействием
высокого напряжения. Использование ускоренного пучка электронов
и герметичных микрокамер позволяет изучать живые объекты (бактерии), хотя и в течение короткого
времени. Объекты, изображенные
на экране, можно фотографировать и получать электронограммы.
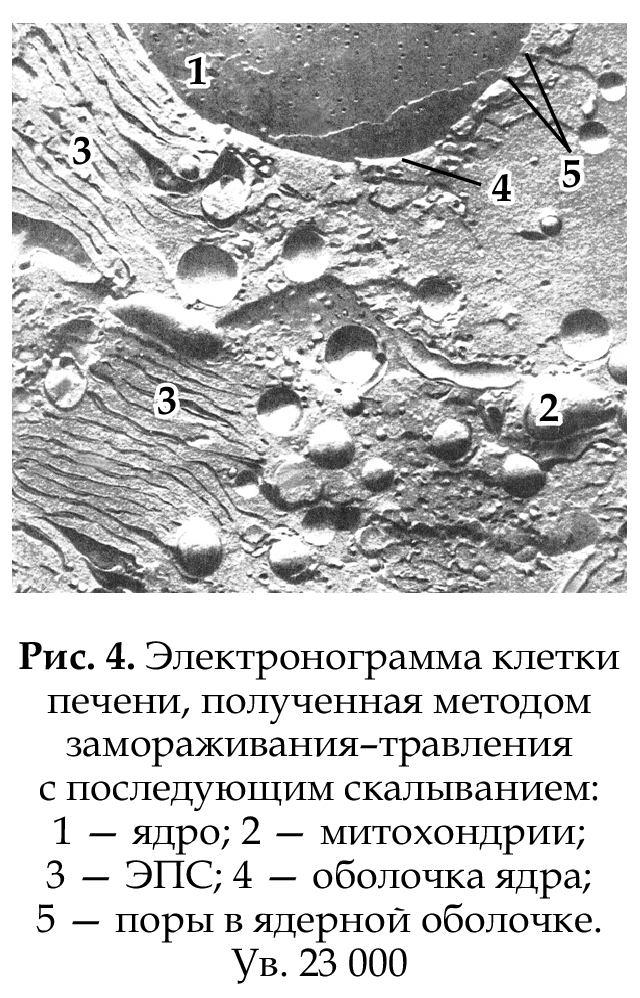
Объемное изображение внутреннего строения клетки можно
получить методом замораживания-травления с последующим
скалыванием материала охлажденным ножом в специальной вакуумной установке. Поверхность скола
последовательно покрывается тонким слоем испаренного углерода, а затем проводят напыление металлом. Таким образом получают пленкреплику, которую и изучают в электронном микроскопе (рис. 4).
Таким образом, разрешающая способность электронного микроскопа в 106 раз выше разрешающей способности глаза и в 103 выше,
чем разрешающая способность светового микроскопа. Различают
трансмиссионную (просвечивающую), сканирующую и высоковольтную электронную микроскопию. Трансмиссионная микроскопия
принципиально сходна со световой, но в колонне микроскопа создается вакуум, так как электроны, сталкиваясь с молекулами газов,
отклоняются и могут не достигать объекта. Использование вакуума
не позволяет исследовать живые объекты. Сканирующий микроскоп создает эффект трехмерности и способен охватывать большие
поверхности. Материал фиксируют, специальным образом высушивают, покрывают тонким слоем испаренного металла (чаще всего
золота), от которого электроны отражаются и попадают в приемное
устройство, передающее сигнал на электронно-лучевую трубку. Используется в биологии для изучения поверхности лейкоцитов, про-
стейших. Высоковольтныймикроскоп позволяет изучать более толстые (до нескольких микрометров) объекты. Это обусловлено усилением проникающей способности электронов в результате увеличения их скорости под воздействием
высокого напряжения. Использование ускоренного пучка электронов
и герметичных микрокамер позволяет изучать живые объекты (бактерии), хотя и в течение короткого
времени. Объекты, изображенные
на экране, можно фотографировать и получать электронограммы.
Объемное изображение внутреннего строения клетки можно
получить методом замораживания-травления с последующим
скалыванием материала охлажденным ножом в специальной вакуумной установке. Поверхность скола
последовательно покрывается тонким слоем испаренного углерода, а затем проводят напыление металлом. Таким образом получают пленкреплику, которую и изучают в электронном микроскопе (рис. 4).
Метод дифференциального центрифугирования основан на разной скорости осаждения (седиментации) отдельных частиц под действием центробежной силы и используется для разделения внутриклеточных структур. Коэффициент седиментации (S) определяется скоростью движения макромолекул в поле с ускорением, равным I, измеряется в единицах, называемых СВЕДБЕРГАМИ. Для определения S используется центрифугирование при высокой скорости (30 000–60 000 об./мин). Исследуемый материал предварительно измельчают в гомогенизаторе. При скоростной седиментации используется среда одинаковой плотности. Компоненты клетки, вначале равномерно распределенные по всему объему пробирки, при центрифугировании оседают каждый со своей скоростью. В результате, содержимое пробирки разделяется на фракции (слои), из которых нижняя представлена самыми тяжелыми структурами, а верхняя — самыми легкими (рис. 5).
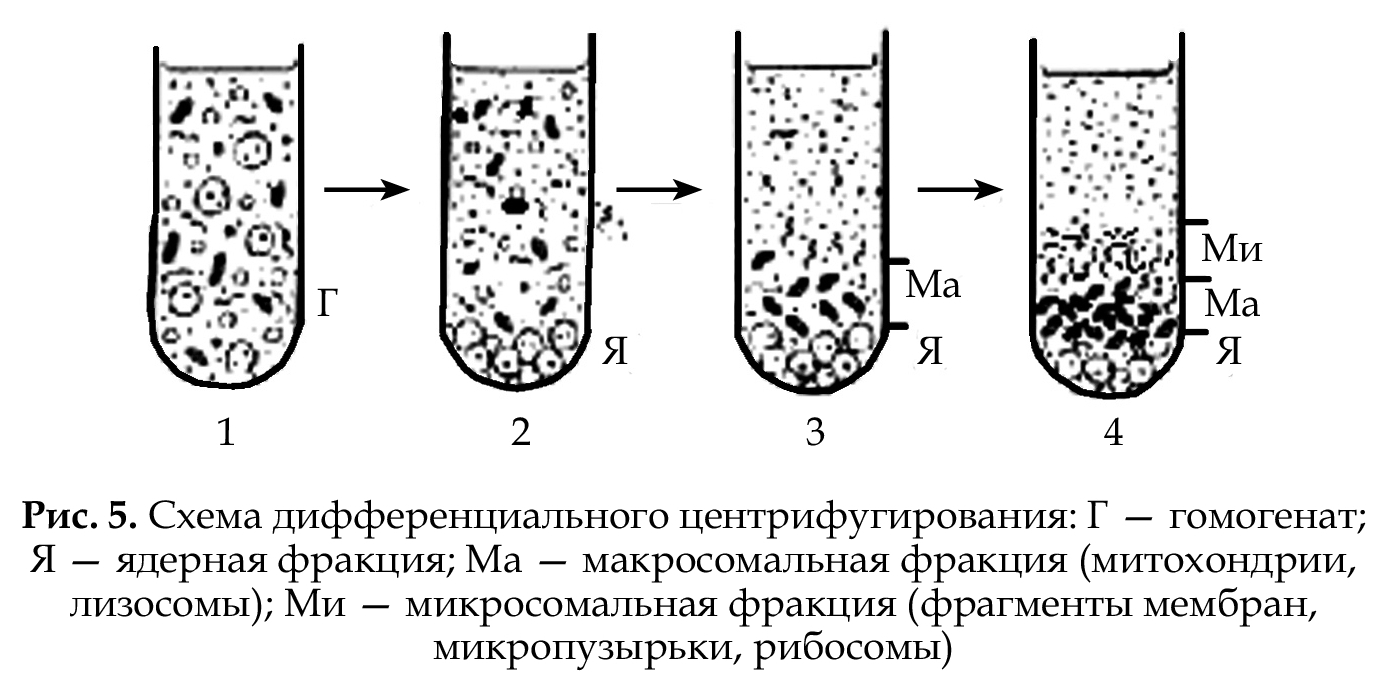
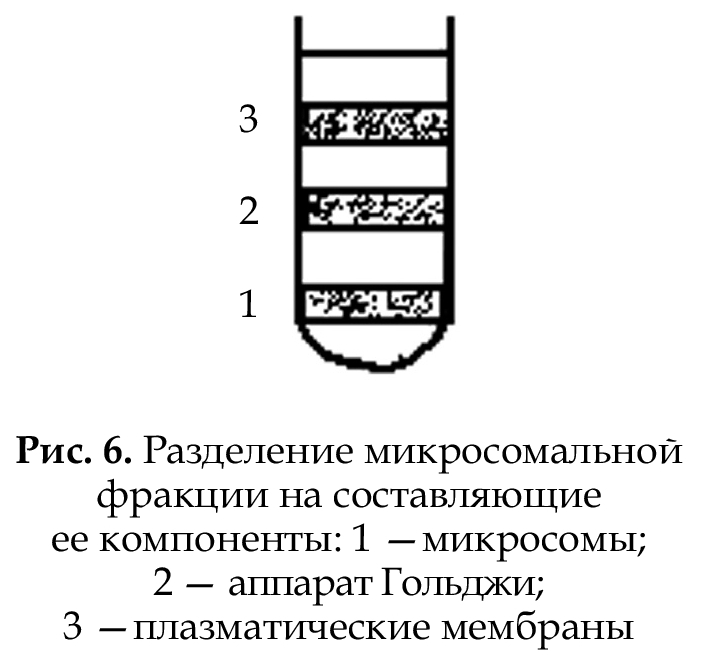 В последующем фракции
(макросомальную и микросомальную) разделяют на отдельные компоненты, исполь-
зуя методы седиментации
в градиенте плотности среды.
Наиболее распространенным
компонентом для получения
градиента среды является сахароза. В процессе центрифугирования субклеточные структуры, входящие в одну
фракцию, концентрируются в
виде отдельных зон в той части пробирки, где молярная концентрация сахарозы обеспечива-
ет такую плотность раствора, при которой дальнейшее оседание
частиц уже не происходит (рис. 6).
Помимо перечисленных методов в цитологии используются и так
называемые пограничные методы:
В последующем фракции
(макросомальную и микросомальную) разделяют на отдельные компоненты, исполь-
зуя методы седиментации
в градиенте плотности среды.
Наиболее распространенным
компонентом для получения
градиента среды является сахароза. В процессе центрифугирования субклеточные структуры, входящие в одну
фракцию, концентрируются в
виде отдельных зон в той части пробирки, где молярная концентрация сахарозы обеспечива-
ет такую плотность раствора, при которой дальнейшее оседание
частиц уже не происходит (рис. 6).
Помимо перечисленных методов в цитологии используются и так
называемые пограничные методы:
― гибридизация нуклеиновых кислот на срезах;
― иммуноцитохимия с при менением моноклональных антител
на световом и электронно-микроскопическом уровне;
― микрохирургия и др.